Quando e como a vacina contra o coronavírus deve chegar ao Brasil?
Ciência trabalha rápido, mas disponibilização depende de fatores técnicos e politização do tema é prejudicial
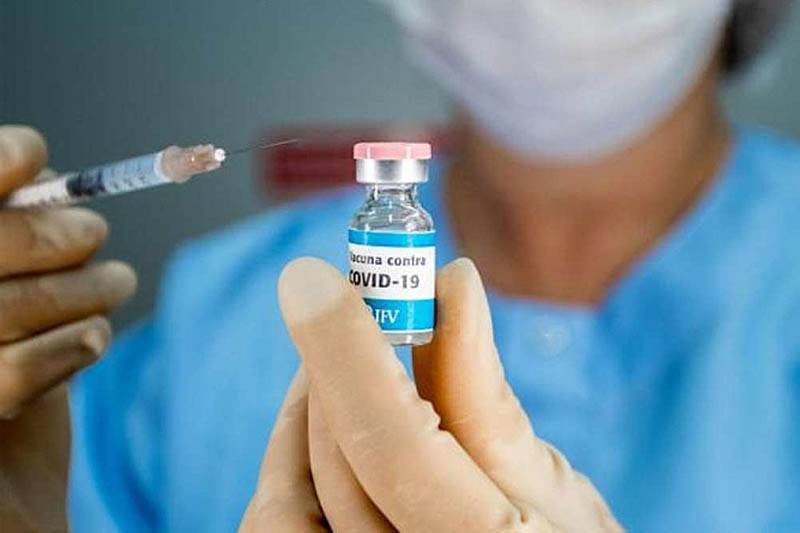 Critérios precisam ser seguidos com rigidez para garantir segurançaAs notícias sobre a possibilidade de uma vacina contra o novo coronavírus ainda nos primeiros meses do próximo ano e com alcance considerável dominaram as discussões sobre o tema nesta semana. No Brasil, a partir da aprovação do imunizante, a vacinação deve ser feita nos mesmos moldes de outras campanhas: pelo Sistema Único de Saúde e respeitando um calendário pré-definido. O país já tem garantias de que terá acesso ao medicamento, mas a disponibilização não será imediata para a toda a população.
Critérios precisam ser seguidos com rigidez para garantir segurançaAs notícias sobre a possibilidade de uma vacina contra o novo coronavírus ainda nos primeiros meses do próximo ano e com alcance considerável dominaram as discussões sobre o tema nesta semana. No Brasil, a partir da aprovação do imunizante, a vacinação deve ser feita nos mesmos moldes de outras campanhas: pelo Sistema Único de Saúde e respeitando um calendário pré-definido. O país já tem garantias de que terá acesso ao medicamento, mas a disponibilização não será imediata para a toda a população.
Na segunda-feira (21) Organização Mundial da Saúde (OMS) anunciou o início dos trabalhos da aliança global Covax. O grupo reúne mais de 150 países e atua para garantir a compra e a distribuição da vacina. A expectativa da OMS é de aquisição de pelo menos 2 bilhões de doses. Três dias depois, o governo federal editou duas medidas provisórias para garantir a participação do Brasil no coletivo.
A movimentação ocorreu em paralelo à divulgação do governo do Estado de São Paulo de que a Coronavac, vacina em estudo na China, não causou efeitos colaterais em 94,7% dos mais de 50 mil voluntários que participam de testes no país asiático. O Instituto Butantan tem parceria com o laboratório responsável pelo imunizante e já realiza testes no Brasil. Na mesma ocasião, o governador João Dória se apressou em anunciar data para a imunização.
"Até 31 de dezembro teremos 46 milhões de doses da vacina Coronavac, e até 28 de fevereiro 60 milhões de doses desta vacina, o que é suficiente para a imunização de todos os brasileiros de São Paulo. Já fizemos negociações com o Ministério da Saúde para que pudessem comprar mais 40 milhões de doses desta mesma vacina para permitir a vacinação de brasileiros de outros estados", disse ele.
Em participação no podcast A Covid -19 na Semana, o médico de família Aristóteles Cardona, da Rede Nacional de Médicas e Médicos Populares, afirma, no entanto, que é temeroso anunciar uma data com os testes ainda em andamento. "É precipitado. Essas fases, esses tempos não existem a toa. Quando a gente vai buscar na história em que se antecipou etapas, a gente teve sérias consequências."
Cardona ressalta ainda que politizar a disponibilização da vacina contra o coronavírus prejudica o debate e pode causar consequências até mesmo para a segurança do processo. "É preciso saber filtrar bem o que Dória tem anunciado, porque não é tão simples como ele faz crer nas declarações (...) Os resultados são promissores, mas a gente precisa ter muita calma, até para não criar uma falsa sensação de segurança. Muita gente já não se preocupa tanto com os cuidados, um anúncio como esse pode fazer com que as pessoas se protejam um pouco menos."
O médico explica que, após a confirmação da eficácia da vacina e aprovação da Agência Nacional de Vigilância Sanitária, será preciso garantir a produção, que depende de tecnologia, capacidade instalada da indústria, insumos e garantias de armazenamento. Depois disso, é preciso definir a logística de distribuição e o calendário, que deve atingir inicialmente os profissionais da saúde e os grupos de risco.
"A gente tem um programa de vacinação que é referência mundial. Esse histórico já nos dá o conhecimento para entender toda a dinâmica do processo. Hoje, a gente não tem capacidade instalada no país para produzir na velocidade e na quantidade que a gente precisa ou está sendo prometida. Isso vale para São Paulo e para todo o Brasil. É muito cedo para termos anúncios."
A percepção de Cardona é semelhante ao que vêm afirmando representantes da OMS. No mundo todo, há mais de 200 vacinas em testes e nove delas estão no portfólio do coletivo global Covax. Ainda assim, recentemente o diretor da instituição, Tedros Adhanom Ghebreyesu, ponderou "Quatro de cada cinco vacinas não chegam à sua comercialização", lembrando que não há garantias de efetividade do que está em estudo.
Existe a possibilidade de que a OMS avalie a liberação de vacinas ainda em testes para uso emergencial, frente à urgência da pandemia. Na sexta-feira (25), a organização publicou os critérios para essa finalidade. Eles estabelecem que os imunizantes precisarão ter passado pelas fases 2 ou 3 dos testes. Será necessário também autorização de agências regulatórias dos países. O documento está disponível para análise da comunidade científica até 08 de outubro.
__________
Brasil de Fato
Cidades
Últimas notícias
16/10/2024 | 12:05
PTB-PA manifesta apoio a Igor Normando no segundo turno das eleições em Belém
10/10/2024 | 06:08
REDE declara apoio a Igor Normando no segundo turno para a Prefeitura de Belém
29/09/2024 | 13:11










